
Asitler Bazlar Ve Tuzlar 10. Sınıf Konu Anlatımı
Asitler, bazlar ve tuzlar, kimyanın temel unsurları olarak günlük yaşamda ve endüstride önemli işlevler üstlenir. Bu makalede, bu maddelerin tanımları, özellikleri ve etkileşimleri detaylı bir şekilde ele alınarak, kimya dersinde başarıya katkı sağlayacak bilgiler sunulacaktır.
Asitler, Bazlar ve Tuzlar: 10. Sınıf Konu Anlatımı Asitler, bazlar ve tuzlar, kimya biliminin temel bileşenleri arasında yer almaktadır. Bu kavramlar, günlük yaşamda ve endüstride önemli bir rol oynamaktadır. Bu yazıda, asitlerin, bazların ve tuzların tanımları, özellikleri, sınıflandırılması ve birbirleriyle olan ilişkileri ele alınacaktır. Asitler Asitler, sulu çözeltilerinde hidrojen iyonu (H⁺) salan maddelerdir. Asitlerin pH değeri 7'den küçüktür. Genel olarak asitler, ekşi bir tada sahiptir ve bazıları korozif özellik gösterir. Asitler, organik ve inorganik olmak üzere iki ana gruba ayrılırlar.
Bazlar Bazlar, sulu çözeltilerinde hidrojen iyonunu (H⁺) bağlayarak hidroksit iyonu (OH⁻) salan maddelerdir. Bazların pH değeri 7'den büyüktür. Genellikle acı bir tada sahiptirler ve kaygan bir his verirler. Bazlar da organik ve inorganik olarak iki gruba ayrılır.
Tuzlar Tuzlar, bir asit ile bir bazın tepkimesi sonucunda oluşan bileşiklerdir. Tuzlar, sulu çözeltilerinde asidik veya bazik özellik gösterebilirler. Tuzların pH değeri, meydana geldikleri asit ve bazın özelliklerine bağlıdır. Tuzlar genellikle kristal yapıda olup, çoğu suda çözünür.
Asit-Baz Tepkimeleri Asitler ve bazlar arasındaki tepkimeler, nötralleşme tepkimeleri olarak adlandırılır. Bu tepkimelerde, bir asit ve bir baz birleşerek su ve bir tuz oluştururlar. Örnek: HCl (aq) + NaOH (aq) → NaCl (s) + H₂O (l) Örnek Uygulamalar Günlük yaşamda asitler, bazlar ve tuzların birçok kullanım alanı vardır:
Test Aşağıda asitler, bazlar ve tuzlar ile ilgili kısa bir test bulunmaktadır: 1. Hangi madde asit olarak kabul edilir?
2. Hangi madde bir bazdır?
3. Asit ve baz arasındaki tepkime sonucunda hangi madde oluşur?
Ekstra Bilgiler Asitler, bazlar ve tuzlar, kimya sanayisinin temel taşlarını oluşturur. Özellikle tarım, gıda, temizlik ve ilaç sektörlerinde büyük öneme sahiptirler. Ayrıca, asit-baz dengesi, canlıların yaşamı için kritik bir öneme sahiptir. İnsan vücudu, asit-baz dengesini korumak için çeşitli mekanizmalara sahiptir. Bu denge, hücrelerin normal işlev görmesi ve metabolizmanın sağlıklı bir şekilde devam etmesi için gereklidir. Sonuç olarak, asitler, bazlar ve tuzlar, kimya biliminin temel bileşenleri olarak hem teorik hem de pratik açıdan büyük bir öneme sahiptir. Bu konu hakkında daha fazla bilgi edinmek, öğrencilerin kimya derslerinde daha başarılı olmalarına katkı sağlayacaktır. |









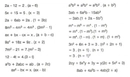























Bu yazıda asitler, bazlar ve tuzlar hakkında verilen bilgiler oldukça kapsamlı. Özellikle asitlerin ve bazların sınıflandırılması ve özellikleri, günlük yaşamda karşımıza çıkan örneklerle desteklenmiş. Asitlerin gıda maddelerinde koruyucu olarak kullanılması ve bazların temizlik ürünlerinde yer alması gibi pratik uygulamalar, bu kavramların önemini vurguluyor. Ayrıca, asit-baz tepkimeleri ve nötürleşme süreci hakkında verilen örnek de, konunun anlaşılmasına yardımcı olmuş. Test kısmı, öğrendiklerimizi pekiştirmek için güzel bir fırsat sunuyor. Ancak, ek bilgilerde asit-baz dengesinin canlılar için neden bu kadar kritik olduğu konusunda daha fazla detay verilseydi, konunun önemi daha iyi anlaşılabilirdi. Sizce, asit-baz dengesi bozulduğunda neler olabilir?
Değerli Vasfi,
Yorumunuz için teşekkür ederim. Asitler, bazlar ve tuzlar konusundaki bilgiler gerçekten de günlük yaşamda sıkça karşılaştığımız kavramlar. Asit-baz dengesi canlılar için son derece hayati bir rol oynamaktadır. Bu denge bozulduğunda, organizmada birçok olumsuz etki görülebilir.
Bozulmanın Sonuçları: Asit-baz dengesinin bozulması, kan pH'ının normal aralığın dışına çıkmasına yol açabilir. Bu durum, asidoz veya alkaloz gibi rahatsızlıklara neden olabilir. Örneğin, asidoz; baş ağrısı, yorgunluk, ve bilinç kaybı gibi belirtilerle kendini gösterebilirken, alkaloz; kas kasılmaları ve sinir sistemi problemleri gibi durumlara yol açabilir.
Önemli Organlar Üzerindeki Etkileri: Özellikle böbrekler ve akciğerler, asit-baz dengesinin korunmasında kritik bir rol oynar. Denge bozulduğunda bu organlar üzerindeki yük artar ve uzun vadede işlevlerini yitirebilirler.
Yorumunuzda belirttiğiniz gibi, asit-baz dengesinin önemi hakkında daha fazla bilgi verilmesi, bu konunun anlaşılmasını güçlendirebilir. Bu tür bilgiler, sağlık alanında da büyük bir farkındalık yaratabilir.
Sizce, bu dengeyi korumak için günlük yaşamda ne gibi önlemler alınabilir?