
11. Sınıf Kimya Gaz Yasaları Konu Anlatımı
Gaz yasaları, gazların fiziksel koşullar altındaki davranışlarını ve özelliklerini açıklayan temel ilkelerdir. Boyle, Charles ve Avogadro yasaları, gazların hacim, basınç ve sıcaklık ilişkilerini anlamamıza yardımcı olur. Bu bilgiler, kimya eğitiminin önemli bir parçasıdır ve birçok uygulama alanında kritik bir rol oynar.
11. Sınıf Kimya Gaz Yasaları Konu Anlatımı Gaz yasaları, gazların davranışlarını açıklayan ve çeşitli fiziksel koşullar altında gazların özelliklerini belirleyen temel ilkelerdir. Gazların davranışını anlamak, birçok kimyasal ve fiziksel süreçte kritik bir öneme sahiptir. Bu nedenle, gaz yasalarının öğrenilmesi, kimya eğitiminin temel taşlarından biridir. Gaz Yasalarının Temel İlkeleri Gaz yasaları, genel olarak üç ana yasa altında toplanabilir:
Boyle Yasası Boyle Yasası, bir gazın sıcaklığı sabitken (isotermal koşullarda) basıncı ile hacmi arasındaki ters orantıyı ifade eder. Bu yasa şu şekilde formüle edilir: P1 × V1 = P2 × V2Burada P, basıncı; V, hacmi; 1 ve 2 ise başlangıç ve son durumları temsil eder. Boyle Yasası, gazların sıkıştırılabilir olduğunu gösterir. Örnek: Bir gazın hacmi 10 L ve basıncı 2 atm ise, hacmi 5 L'ye düşürüldüğünde basıncı ne olur? Çözüm: P1 = 2 atm, V1 = 10 L, V2 = 5 LP2 = (P1 × V1) / V2 = (2 atm × 10 L) / 5 L = 4 atmGazın yeni basıncı 4 atm olur. Charles Yasası Charles Yasası, bir gazın basıncı sabitken (izobarik koşullarda) hacminin, sıcaklıkla doğru orantılı olduğunu belirtir. Bu yasa şu şekilde ifade edilir: V1 / T1 = V2 / T2Burada T, sıcaklığı (Kelvin cinsinden) temsil eder. Charles Yasası, sıcaklık arttıkça gazın hacminin de arttığını gösterir. Örnek: Bir gazın hacmi 20 L ve sıcaklığı 300 K ise, sıcaklığı 600 K'ye çıkardığında hacmi ne olur?Çözüm: V1 = 20 L, T1 = 300 K, T2 = 600 KV2 = (V1 × T2) / T1 = (20 L × 600 K) / 300 K = 40 LGazın yeni hacmi 40 L olur. Avogadro Yasası Avogadro Yasası, aynı sıcaklık ve basınç altında eşit hacimlerde bulunan gazların, molekül sayısının eşit olduğunu belirtir. Bu yasa şu şekilde ifade edilir: V / n = kBurada V hacmi, n mol sayısını ve k ise sabiti temsil eder. Bu yasa, gazların mol sayısı ile hacmi arasında doğrudan bir ilişki olduğunu gösterir. Örnek: 1 mol gaz 22.4 L hacim kaplarsa, 3 mol gaz kaç L hacim kaplar?Çözüm: V = n × 22.4 L/mol = 3 mol × 22.4 L/mol = 67.2 L3 mol gaz 67.2 L hacim kaplar. Gaz Yasalarının Uygulamaları Gaz yasaları, birçok alanda uygulama bulur. Örneğin, hava balonları, otomobillerin motorları, solunum sistemleri gibi birçok sistem gazların özelliklerine dayanmaktadır. Ayrıca, gaz yasaları, kimyasal reaksiyonların hesaplanmasında ve endüstriyel süreçlerde de büyük öneme sahiptir. Test Aşağıdaki soruları cevaplayarak gaz yasaları konusundaki bilginizi test edebilirsiniz:
Sonuç Gaz yasaları, gazların davranışlarının anlaşılması açısından kritik bir önem taşır. Bu yasaların öğrenilmesi, öğrencilerin kimya konularında daha derin bir anlayış kazanmalarına yardımcı olur. Gaz yasalarının günlük yaşamda ve birçok bilimsel uygulamada nasıl kullanıldığını anlamak, modern bilimin temel taşlarından birini oluşturmaktadır. Gazların özellikleri üzerine yapılan çalışmalar, gelecekte yeni teknolojilerin ve yenilikçi çözümlerin geliştirilmesine katkı sağlayabilir. |















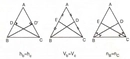
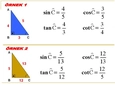

















Gaz yasalarının bu kadar önemli olduğunu öğrendiğinizde, gerçekten de günlük hayatta karşılaştığımız pek çok durumu daha iyi anlamaya başlıyoruz. Örneğin, Boyle Yasası'nın bir gazın hacmi ile basıncı arasındaki ters orantıyı nasıl açıkladığını düşündüğünüzde, bir balonun havasını sıkıştırdığınızda hacminin küçüldüğünü ve basıncının arttığını görebiliyoruz. Bu durum, belki de günlük yaşamda en çok karşılaştığımız örneklerden biri. Aynı şekilde, Charles Yasası'nın sıcaklık ile hacim arasındaki doğru orantıyı belirlemesi, özellikle hava balonlarının havada yükselmesi gibi olayları anlamamıza yardımcı oluyor. Sıcaklık arttıkça, balondaki gazın hacminin de arttığını gözlemlemek oldukça ilginç. Avogadro Yasası ise moleküllerin sayısı ve hacim arasındaki ilişkiyi net bir şekilde ortaya koyuyor. Eşit hacimlerdeki gazların moleküllerinin sayısının eşit olması, gazların doğası hakkında düşündüğümüzde bize önemli bilgiler veriyor. Tüm bu yasaların günlük yaşamda ve bilimsel uygulamalarda nasıl işlediğini görmek, kimya derslerinin ne kadar eğlenceli ve öğretici olabileceğini gösteriyor. Gaz yasaları hakkında daha fazla bilgi edinmek istemez misiniz?
Afafet,
Gaz Yasalarının Önemi
Gaz yasalarının günlük yaşamda ne kadar önemli olduğunu vurgulaman çok yerinde. Bu yasalar, basit bir balonun içindeki gazın davranışını anlamaktan, hava balonlarının yükselmesine kadar pek çok olayda karşımıza çıkıyor. Boyle Yasası'nın hacim ve basınç arasındaki ters orantıyı göstermesi, gazların fiziksel özelliklerini anlamamızda büyük bir rol oynuyor.
Charles Yasası ve Sıcaklık
Charles Yasası'nın sıcaklık ve hacim arasındaki doğru orantı ilişkisi, gerçekten de hava balonları gibi somut örneklerle pekişiyor. Sıcaklık arttıkça gazın hacminin de artması, doğada gözlemlediğimiz bir durum. Bu tür ilişkiler, gazların davranışlarını tahmin etmemizi kolaylaştırıyor ve fiziksel olayları anlamamıza yardımcı oluyor.
Avogadro Yasası'nın Rolü
Avogadro Yasası'nın moleküllerin sayısı ile hacim arasındaki ilişkiyi net bir şekilde ortaya koyması, gazların doğasına dair önemli bilgiler sunuyor. Eşit hacimlerdeki gazların moleküllerinin sayısının eşit olması, kimya alanında önemli bir temel oluşturuyor.
Sonuç
Sonuç olarak, gaz yasalarının günlük yaşamda uygulamalarını görmek, kimya derslerinin eğlenceli ve öğretici yönlerini de gözler önüne seriyor. Gazlarla ilgili daha fazla bilgi edinmek, bu olayların arkasındaki bilimsel ilkeleri daha iyi anlamamıza yardımcı olacaktır. Kimya ile ilgili merak ettiğin başka konular varsa, her zaman konuşmaya hazırız!