
10. Sınıf Kimya Asit Ve Bazlar Konu Anlatımı
Asitler ve bazlar, kimya biliminin temel yapı taşlarından biridir ve birçok alanda önemli işlevlere sahiptir. Bu içerik, asit ve bazların özelliklerini, tanımlarını ve tepkimelerini açıklamakta, ayrıca konuyu pekiştirmek için test soruları sunmaktadır. Eğitim sürecine katkı sağlamak amacıyla hazırlanmıştır.
10. Sınıf Kimya Asit ve Bazlar Konu Anlatımı Asitler ve bazlar, kimya biliminin temel konularından birini oluşturur. Bu iki grup madde, günlük yaşamdan endüstriyel uygulamalara kadar birçok alanda önemli rol oynamaktadır. Asitler, genellikle hidrojen iyonu (H⁺) bağışlayabilen maddeler olarak tanımlanırken, bazlar ise hidrojen iyonu alabilen veya hidroksit iyonu (OH⁻) veren maddeler olarak tanımlanır. Bu konu anlatımında asitler ve bazlar hakkında detaylı bilgi verilecek, örnekler sunulacak ve konunun daha iyi anlaşılabilmesi için küçük bir test hazırlanacaktır. Asitlerin Özellikleri Asitler, su içinde çözündüklerinde asidik özellikler gösterirler. Genel özellikleri şunlardır:
Örnek asitler arasında hidroklorik asit (HCl), sülfürik asit (H₂SO₄) ve nitrik asit (HNO₃) bulunur. Bazların Özellikleri Bazlar, asitlerin zıt özelliklerini taşır. Bazların özellikleri şunlardır:
Örnek bazlar arasında sodyum hidroksit (NaOH), potasyum hidroksit (KOH) ve amonyak (NH₃) yer alır. Asit-Baz Teorileri Asit ve bazların tanımlanmasında farklı teoriler geliştirilmiştir. Bunlardan en yaygın olanları:
Bu teoriler, asit ve bazların kimyasal davranışlarını anlamada önemli bir rol oynamaktadır. Asit-Baz Tepkimeleri Asit ve bazlar arasındaki tepkimelere nötralleşme tepkimeleri denir. Bu tepkimelerde asit ve baz bir araya gelerek su ve tuz oluştururlar. Örneğin: HCl + NaOH → NaCl + H₂OBu tepkimede hidroklorik asit (HCl) ve sodyum hidroksit (NaOH) bir araya gelerek sodyum klorür (NaCl) ve su (H₂O) oluşturur. Test Aşağıdaki soruları cevaplayarak konuyu pekiştirebilirsiniz:
Ekstra Bilgiler Asit ve bazların birçok endüstriyel ve bilimsel uygulamaları bulunmaktadır. Örneğin, sülfürik asit, gübre üretiminde ve pil yapımında yaygın olarak kullanılırken, sodyum hidroksit temizlik ürünlerinde ve kağıt üretiminde kullanılmaktadır. Ayrıca, asit-baz dengesi insan vücudunda da büyük öneme sahiptir; vücuttaki pH seviyesinin denge içinde tutulması sağlık açısından kritik bir faktördür.Asitler ve bazlar hakkında daha fazla bilgi edinmek, kimya alanında derin bir anlayış geliştirmek için önemlidir. Bu konunun, kimya dersleri ve laboratuvar uygulamaları açısından temel bir yapı taşı olduğunu unutmamak gerekir. |









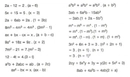























Asit ve bazlar konusunu ele alırken, bu maddelerin günlük yaşamımızda ne kadar önemli bir yer kapladığını fark ettiniz mi? Özellikle asitlerin ekşi tadı ve bazların acı tadı, onları ayırt etmekte oldukça yardımcı oluyor. Ayrıca, pH değerinin 7'den düşük olması asitlerin, 7'den yüksek olması ise bazların özelliklerinden biri. Bu bilgileri kullanarak çevrenizdeki maddeleri daha iyi analiz edebiliriz. Asit-baz tepkimeleri ise oldukça ilginç; bir asit ve bazın birleşerek nasıl tuz ve su oluşturduğunu görmek, kimya derslerinin en eğlenceli taraflarından biri değil mi? Teoriler arasında Arrhenius, Brønsted-Lowry ve Lewis gibi farklı bakış açıları, bu konunun derinliğini ve zenginliğini artırıyor. Acaba, günlük hayatta sıkça karşılaştığımız asit ve bazları tanıyabiliyor muyuz?
Asit ve Bazların Önemi
İmareddin, asit ve bazların günlük yaşamımızda ne kadar önemli olduğunu vurgulaman harika! Gerçekten de, bu maddeler çoğu gıda ve temizlik ürünlerinde yer almakta. Ekşi tatlar asitlerin, acı tatlar ise bazların tipik özellikleri. Bu tatları tanımak, gıdaların içeriğini anlamamıza yardımcı oluyor.
pH Değeri ve Analiz
pH değerinin 7'den düşük olması asitleri, yüksek olması ise bazları tanımlamakta oldukça pratik bir yöntem. Bu sayede çevremizdeki maddeleri daha bilinçli bir şekilde analiz edebiliriz. Örneğin, limon suyu ve sirke gibi asidik maddeleri tanımak hayatımızı kolaylaştırıyor.
Asit-Baz Tepkimeleri
Asit-baz tepkimeleri gerçekten de kimya derslerinin en eğlenceli yanlarından biri! Bir asidin bir baz ile birleşerek tuz ve su oluşturması, kimyanın temel prensiplerinden birini gözler önüne seriyor. Bu süreçleri gözlemlemek, öğrenmeyi daha keyifli hale getiriyor.
Farklı Teoriler
Arrhenius, Brønsted-Lowry ve Lewis gibi teoriler, asit ve baz kavramlarına farklı bakış açıları sunarak konunun derinliğini artırıyor. Bu teoriler sayesinde, asit ve bazların nasıl etkileştiğini daha iyi anlıyoruz.
Günlük Hayatta Tanıma
Günlük hayatta sıkça karşılaştığımız asit ve bazları tanıyabiliyor muyuz? Belki de evde kullandığımız temizlik malzemeleri veya yemeklerdeki tatlar sayesinde bu maddeleri daha iyi ayırt edebiliyoruzdur. Bu bilgilerin farkında olmak, hem sağlığımızı korumak hem de daha bilinçli seçimler yapmak açısından oldukça önemli.