
Gazlar Konu Anlatımı ve İçeriği
Gazlar, maddenin en temel hallerinden biri olup, belirli bir hacim ve şekil almadan bulundukları ortamda yayılma özelliğine sahiptir. Fiziksel ve kimyasal özellikleri ile diğer madde halleri arasında farklılık gösterir. Bu içerikte gazların temel özellikleri, davranış kanunları ve çeşitli uygulama alanları detaylı bir şekilde incelenmektedir.
Gazlar Konu Anlatımı ve İçeriği Gazlar, maddenin temel halleri arasında yer almakta olup, belirli bir hacim ve şekil almadan, bulundukları ortamın her tarafına yayılma özelliğine sahip olan maddelerdir. Gazların fiziksel ve kimyasal özellikleri, diğer madde hallerine (katı ve sıvı) göre farklılıklar göstermektedir. Bu makalede gazların temel özellikleri, davranışları ve uygulama alanları detaylı bir şekilde ele alınacaktır. Gazların Temel Özellikleri Gazların bazı temel özellikleri şunlardır:
Gazların Davranış Kanunları Gazların davranışlarını açıklayan birkaç temel yasa bulunmaktadır:
Gazların Kimyasal Özellikleri Gazlar, kimyasal reaksiyonlara katılabilme özelliğine sahiptir. Bu özellik, gazların reaktifliğine ve moleküler yapısına bağlı olarak değişiklik gösterir. Örneğin:
Gazların Uygulama Alanları Gazların çeşitli endüstriyel ve günlük yaşamda birçok uygulama alanı bulunmaktadır:
Sonuç Gazlar, fiziksel ve kimyasal özellikleri itibariyle oldukça önemli bir madde grubudur. Günlük yaşamda ve endüstride birçok alanda kullanılmakta olan gazların davranışlarını anlamak, bilim ve teknoloji alanında ilerlemeler kaydetmek adına büyük bir öneme sahiptir. Gazların özellikleri ve davranışları üzerine yapılan araştırmalar, daha etkili ve verimli uygulamaların geliştirilmesine olanak tanımaktadır. Bu makalede, gazların temel özellikleri, davranış kanunları, kimyasal özellikleri ve uygulama alanları kapsamlı bir şekilde ele alınmış olup, gazların bilim ve sanayi üzerindeki etkileri vurgulanmıştır. Gazlar, modern bilimin ve teknolojinin önemli bir parçası olmaya devam edecektir. |










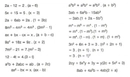























Gazların kinetik enerjilerinin sıcaklıkla doğru orantılı olduğunu söylediniz. Peki, sıcaklığı artırdığımızda gaz moleküllerinin hızının neden arttığını biraz daha detaylı açıklayabilir misiniz? Bu durumun gazların basıncına ve yoğunluğuna etkisi nedir?
Elbette Vecih, gaz moleküllerinin kinetik enerjilerinin sıcaklıkla nasıl değiştiğini detaylı bir şekilde açıklamak memnuniyet verici.
Kinetik Enerji ve Sıcaklık İlişkisi:
Gaz moleküllerinin kinetik enerjisi, sıcaklık ile doğrudan orantılıdır. Bu, moleküllerin hareket enerjilerinin sıcaklık artışıyla birlikte arttığı anlamına gelir. Temel olarak, sıcaklık arttıkça gaz moleküllerinin ortalama kinetik enerjisi de artar. Moleküller daha hızlı hareket etmeye başlar çünkü sıcaklık, moleküllere enerji verir ve bu enerji, moleküllerin hızını artırır.
Hız ve Kinetik Enerji:
Bir gazın sıcaklığını artırdığınızda, moleküllerin kinetik enerjisi artar ve bu da onların hızlanmasına neden olur. Kinetik enerji formülü E = 1/2 mv² (m: kütle, v: hız) ile ifade edilir. Sıcaklık artışı, moleküllerin hızını artırır çünkü enerjinin büyük bir kısmı hızın karesi ile ilişkilidir.
Basınç ve Yoğunluk Üzerindeki Etkiler:
- Basınç: Gaz molekülleri daha hızlı hareket ettikçe, kap içinde daha sık ve daha güçlü çarpışmalar yaparlar. Bu da gazın basıncını artırır. Örneğin, sabit bir hacimdeki gazın sıcaklığını artırırsanız, gaz molekülleri daha hızlı hareket eder ve daha fazla basınç uygular.
- Yoğunluk: İdeal gaz yasasına göre (PV = nRT), sıcaklık (T) arttığında ve hacim (V) sabit kaldığında, basınç (P) artar. Aynı zamanda, yoğunluk (d = m/V) sabit bir hacimde değişmez, ancak hacim genişlediğinde yoğunluk azalır.
Umarım bu açıklamalar, gazların kinetik enerjilerinin sıcaklıkla nasıl değiştiğini ve bu değişimin gazların basıncı ve yoğunluğu üzerindeki etkilerini daha iyi anlamana yardımcı olur.