
Kimyasal Tepkimeler 10. Sınıf Konu Anlatımı
Kimyasal tepkimeler, maddelerin etkileşimiyle yeni maddelerin oluşumunu sağlayan süreçlerdir. Bu tepkimeler, doğadaki birçok olayı etkilerken, kimya eğitiminin temelini oluşturur. Öğrencilerin bu konuyu anlaması, daha ileri kimya konularında başarılı olmalarına yardımcı olur.
Kimyasal Tepkimeler Kimyasal tepkimeler, bir veya birden fazla maddenin kimyasal değişime uğrayarak yeni maddelerin oluşmasına yol açan süreçlerdir. Bu süreçler, doğada sürekli olarak gerçekleşmekte ve birçok alanı etkilemektedir. Kimyasal tepkimeler, maddenin yapısını, özelliklerini ve enerjisini değiştirerek gerçekleşir. Bu bağlamda, 10. sınıf düzeyinde kimyasal tepkimeleri anlamak, öğrencilerin kimya dersinde daha ileri konuları öğrenmelerine yardımcı olur. Kimyasal Tepkimenin Tanımı Kimyasal tepkime, başlangıç maddeleri (reaktifler) arasında bir etkileşim sonucu, yeni maddelerin (ürünler) oluşmasıdır. Tepkime sırasında atomlar yeniden düzenlenir, bağlar kırılır ve yeni bağlar oluşur. Tepkime denklemleri, bu değişiklikleri göstermek için kullanılır ve genellikle aşağıdaki şekilde yazılır:\[ \text{Reaktifler} \rightarrow \text{Ürünler} \] Tepkime Türleri Kimyasal tepkimeler çeşitli türlere ayrılabilir. Bunlar:
1. Birleşme Tepkimeleri Birleşme tepkimeleri, iki veya daha fazla reaktifin bir araya gelerek tek bir ürün oluşturduğu tepkimelerdir. Örneğin:\[ \text{A} + \text{B} \rightarrow \text{AB} \]Örnek: Karbon dioksit ve su moleküllerinin birleşerek glikoz oluşturduğu fotosentez tepkimesi. 2. Ayrışma Tepkimeleri Ayrışma tepkimeleri, bir bileşiğin ısı, elektrik veya kimyasal etki ile daha basit bileşenlerine ayrılmasını sağlar. Örneğin:\[ \text{AB} \rightarrow \text{A} + \text{B} \]Örnek: Su molekülünün elektroliz ile hidrojen ve oksijen gazlarına ayrılması. 3. Yer Değiştirme Tepkimeleri Yer değiştirme tepkimeleri, bir elemanın başka bir bileşikteki bir eleman ile yer değiştirmesi ile gerçekleşir. Örneğin:\[ \text{A} + \text{BC} \rightarrow \text{AC} + \text{B} \]Örnek: Çinko ve bakır sülfat çözeltisinin tepkimesi. 4. Çift Yer Değiştirme Tepkimeleri Çift yer değiştirme tepkimeleri, iki bileşiğin birbirleriyle değişerek yeni bileşenler oluşturduğu tepkimelerdir. Örneğin:\[ \text{AB} + \text{CD} \rightarrow \text{AD} + \text{CB} \]Örnek: Sodyum klorür ve gümüş nitratının tepkimesi. 5. Yanma Tepkimeleri Yanma tepkimeleri, genellikle bir organik bileşiğin oksijenle tepkimeye girerek ısı ve ışık açığa çıkardığı tepkimelerdir. Örneğin:\[ \text{C}_x\text{H}_y + \text{O}_2 \rightarrow \text{CO}_2 + \text{H}_2\text{O} \]Örnek: Metanın yanması. Kimyasal Tepkimelerin Dengelenmesi Kimyasal tepkimelerin denklemleri, atomların sayısının tepkimenin her iki tarafında da eşit olmasını sağlamak için dengelenmelidir. Bu, kütlenin korunumu ilkesine dayanmaktadır. Örneğin:\[ \text{2H}_2 + \text{O}_2 \rightarrow \text{2H}_2\text{O} \] Test Soruları Aşağıdaki testte kimyasal tepkimeler ile ilgili bilgilerinizi ölçebilirsiniz:
Sonuç Kimyasal tepkimeler, kimya biliminin temel taşlarından biridir. Bu tepkimeleri anlamak, öğrencilerin daha karmaşık kimyasal olayları kavramalarına yardımcı olur. Bu nedenle, kimyasal tepkimelerin türleri ve özellikleri hakkında bilgi sahibi olmak, kimya dersinde başarılı olmanın anahtarıdır. Kimyasal tepkimelerin, günlük yaşamda ve endüstrideki uygulamaları da göz önünde bulundurulduğunda, bu konunun önemi daha da artmaktadır. |









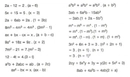























Kimyasal tepkimelerin tanımı ve türleri oldukça ilginç bir konu. Özellikle birleştirme tepkimeleri ve ayrışma tepkimeleri arasındaki farkları anlamak, kimyanın temelini kavramak açısından çok önemli. Mesela, su molekülünün elektroliz ile hidrojen ve oksijen gazlarına ayrılması aklımda hep kalmıştır. Bu tür tepkimelerin hem teorik hem de pratik anlamda birçok uygulaması var. Ayrıca, yanma tepkimelerinin enerjinin açığa çıkması açısından önemi de göz ardı edilemez. Kimyasal tepkimelerin dengelenmesi ise kütlenin korunumu ilkesine dayandığı için gerçekten dikkat edilmesi gereken bir konu. Öğrenciler olarak bu bilgileri öğrenmek, ileride daha karmaşık kimyasal olayları anlamamız için elzem. Sizce kimyasal tepkimelerin günlük yaşamda ne gibi etkileri var?
Kimyasal Tepkimelerin Önemi
Işınner, kimyasal tepkimelerin günlük yaşam üzerindeki etkileri oldukça geniş bir yelpazeye yayılmaktadır. Öncelikle, kimyasal tepkimeler sayesinde yaşamsal fonksiyonlarımızı sürdürebiliyoruz. Örneğin, solunum ve sindirim süreçleri tamamen kimyasal tepkimelere dayanır.
Enerji Üretimi
Bir diğer önemli etkisi ise enerji üretimidir. Yanma tepkimeleri, fosil yakıtların enerjiye dönüştürülmesinde kritik bir rol oynar. Bu enerji, hem sanayide hem de evlerde günlük yaşamı kolaylaştıran birçok uygulama için kullanılır.
Temizlik ve Hijyen
Temizlik ürünleri de kimyasal tepkimeleri temel alır. Örneğin, deterjanlar su ile etkileşime geçerek kirleri çözmeye yardımcı olur.
Gıda ve Beslenme
Gıda kimyası da bu bağlamda önemli bir alan. Gıdaların işlenmesi, korunması ve lezzetlendirilmesi gibi süreçler, kimyasal tepkimelerle doğrudan ilişkilidir.
Çevresel Etkiler
Son olarak, kimyasal tepkimelerin çevresel etkileri de göz ardı edilmemelidir. Hava kirliliği ve iklim değişikliği gibi sorunlar, kimyasal tepkimelerin yan ürünleri olarak ortaya çıkmaktadır.
Sonuç olarak, kimyasal tepkimelerin günlük yaşamda kayda değer birçok etkisi bulunmaktadır ve bu konuyu anlamak, hem bireysel hem de toplumsal olarak daha bilinçli kararlar almamıza yardımcı olur.