
Elektrokimya Konu Anlatımı ve İçeriği
Elektrokimya, elektrik ve kimya arasındaki etkileşimleri inceleyen bir bilim dalıdır. Kimyasal reaksiyonların elektrik akımı ile nasıl tetiklendiği veya etkilendiği üzerine odaklanır. Enerji dönüşümleri, elektroliz süreçleri ve pil teknolojileri gibi geniş uygulama alanlarına sahiptir.
Elektrokimya Nedir?Elektrokimya, elektrik ve kimya arasındaki etkileşimleri inceleyen bir bilim dalıdır. Temel olarak, kimyasal reaksiyonların elektrik akımı ile tetiklendiği veya elektrik akımının kimyasal reaksiyonları etkilediği durumları ele alır. Elektrokimya, enerji dönüşümleri, elektrot kimyası, elektroliz, pil teknolojileri ve korozif süreçler gibi birçok uygulama alanına sahiptir. Elektrokimyanın Temel İlkeleri Elektrokimya, birkaç temel ilke üzerine kuruludur. Bu ilkeler, elektrik akımının ve kimyasal reaksiyonların nasıl etkileşimde bulunduğunu anlamamıza yardımcı olur.
Elektrokimyasal Hücreler Elektrokimyasal hücreler, kimyasal enerjiyi elektrik enerjisine dönüştüren veya elektrik enerjisini kimyasal enerjiye dönüştüren sistemlerdir. İki ana türü vardır: galvanik hücreler ve elektrolitik hücreler.
Elektroliz Süreci Elektroliz, bir elektrolitik hücrede elektrik akımının uygulanmasıyla gerçekleştirilen kimyasal bir süreçtir. Bu süreç, çözeltide bulunan iyonların hareket etmesine ve elektrotlarda reaksiyonların gerçekleşmesine yol açar. Elektroliz, metal ayırma, suyun parçalanması ve çeşitli kimyasalların üretimi gibi birçok endüstriyel uygulamada kullanılır.
Pil Teknolojileri Elektrokimya, pil teknolojilerinin temelini oluşturur. Pil, kimyasal enerjiyi elektrik enerjisine dönüştüren bir elektrokimyasal hücredir. Farklı pil türleri, çeşitli kimyasal bileşenler ve yapılandırmalar kullanarak enerji depolar ve serbest bırakır.
Korozif Süreçler Elektrokimya, metallerin ve alaşımların korozyon süreçlerini anlamada da kritik bir rol oynar. Korozyon, bir metalin çevresindeki ortam ile etkileşime girmesi sonucu meydana gelen kimyasal bir reaksiyondur.
Sonuç Elektrokimya, kimya ve elektrik arasındaki ilişkileri inceleyen önemli bir alandır. Enerji dönüşümleri, elektroliz süreçleri, pil teknolojileri ve korozif olaylar gibi birçok uygulama alanı ile bilimsel ve endüstriyel anlamda geniş bir etki alanına sahiptir. Elektrokimyasal sistemlerin anlaşılması, hem temel bilimsel araştırmalar hem de pratik uygulamalar açısından büyük bir öneme sahiptir. Bu bilgiler, elektrokimya alanındaki temel kavramları ve uygulamaları anlamada yardımcı olacaktır. Elektrokimya, gelecekte enerji üretimi ve depolama gibi kritik konularda yenilikçi çözümler geliştirmek için önemli bir temel sağlamaktadır. |










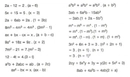























Elektrokimya alanında pek çok ilginç kavram mevcut. Özellikle aktiflik konusunun üç başlık altında incelenmesi dikkatimi çekti. Yükseltgenme ve indirgenme potansiyeli arasındaki ilişki, bir metalin ne kadar aktif olduğunu anlamak için önemli bir kriter gibi görünüyor. Pillerde anot ve katot arasındaki farkları anlamak da oldukça kritik. Pil reaksiyonlarının pozitif potansiyel taşıması, kendi kendine çalışma özelliği kazandırıyormuş. Tuz köprüsü olayının pilin çalışmasında nasıl bir rol oynadığı konusunu merak ediyorum. Ayrıca elektroliz sürecinin, elektrik enerjisi ile kimyasal tepkimeleri nasıl etkilediği de benim için oldukça ilginç. Elektrolitlerin özellikleri ve farklı katyonların indirgenme sırasındaki önceliği hakkında daha fazla bilgi edinmek isterim. Siz bu konularda ne düşünüyorsunuz?
Merhaba Timuröz,
Elektrokimya ve Aktiflik
Elektrokimya, gerçekten de birçok ilginç kavramı içinde barındırıyor. Aktiflik, bir metalin ne kadar reaktif olduğunu belirlemede önemli bir faktör ve bu, yükseltgenme ve indirgenme potansiyelleri arasındaki ilişki ile doğrudan bağlantılı. Metallerin aktiflik sırasını belirlemek, kimyasal tepkimelerin yönünü ve hızını anlamak açısından kritik bir öneme sahip.
Pillerde Anot ve Katot
Pillerde anot ve katot arasındaki farklar, enerji üretimi açısından oldukça kritik. Anot, yükseltgenme tepkimesinin gerçekleştiği yerken, katot, indirgenme tepkimesinin gerçekleştiği yerdir. Pilin pozitif potansiyel taşıması, enerji akışının yönünü belirler ve bu da pilin verimliliğini etkiler.
Tuz Köprüsü ve Elektroliz
Tuz köprüsü, elektrokimyasal hücrelerin dengeyi sağlamasında önemli bir rol oynar. İyonların hareketi sayesinde elektrik akımının sürekliliğini sağlar ve hücre içindeki yük dengesini korur. Elektroliz sürecinde ise, elektrik enerjisi kimyasal tepkimeleri başlatarak maddelerin ayrışmasını sağlar. Bu süreç, elektrik enerjisinin kimyasal enerjiye dönüştürülmesine olanak tanır.
Elektrolitlerin Özellikleri
Elektrolitlerin özellikleri, özellikle farklı katyonların indirgenme sırasındaki önceliği, elektroliz sürecinin etkinliğini belirler. Her katyonun farklı bir indirgenme potansiyeli vardır, bu da hangi katyonun önce indirgeneceğini belirler. Bu konudaki derinlemesine bilgi, elektroliz ve pillerin tasarımında büyük önem taşır.
Bu konular üzerine düşünceleriniz ve merak ettikleriniz oldukça değerli. Elektrokimya, sürekli gelişen bir alan ve daha fazla bilgi edinmek her zaman faydalı olacaktır.