
11. Sınıf Kimya Gazlar Konu Anlatımı
Gazlar, belirli bir şekil ve hacmi olmayan, düşük yoğunluğa sahip maddelerdir. Fiziksel ve kimyasal özellikleri çeşitli gaz yasalarıyla açıklanır. Bu içerikte gazların temel özellikleri, gaz yasaları ve uygulama alanları ele alınmaktadır. Gazların davranışları termodinamik çerçevesinde incelenir.
11. Sınıf Kimya Gazlar Konu Anlatımı Gazlar, madde hâlinden biri olup, belirli bir şekli ve hacmi olmayan, bulundukları kabın tamamını dolduran ve genellikle düşük yoğunluğa sahip olan maddelerdir. Gazların davranışları, fiziksel ve kimyasal özellikleri, çeşitli gaz yasaları ile açıklanmaktadır. Bu yazıda, gazların temel özellikleri, gaz yasaları ve bunların uygulamaları üzerinde durulacaktır. Gazların Temel Özellikleri Gazların bazı temel özellikleri şunlardır:
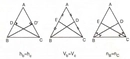
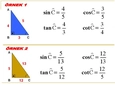
Gaz Yasaları Gazların davranışlarını tanımlayan birkaç temel yasa bulunmaktadır. Bunlar arasında en önemli olanları şunlardır: 1. Boyle Yasası Boyle yasası, sabit sıcaklıkta bir gazın hacmi ile basıncı arasındaki ters orantıyı ifade eder. Yani, bir gazın hacmi, basıncı ile ters orantılıdır. Matematiksel olarak ifade edersek:\[ P_1 V_1 = P_2 V_2 \]Bu denklemde \( P \) basıncı, \( V \) hacmi temsil eder. 2. Charles Yasası Charles yasası, sabit basınçta bir gazın hacminin, sıcaklık ile doğru orantılı olduğunu belirtir. Matematiksel olarak:\[ \frac{V_1}{T_1} = \frac{V_2}{T_2} \]Burada \( T \) sıcaklık (Kelvin cinsinden) ve \( V \) hacmi ifade eder. 3. Avogadro Yasası Avogadro yasası, sabit sıcaklık ve basınç altında, eşit hacimdeki gazların, eşit sayıda molekül içerdiğini belirtir. Bu yasa, gazların mol sayısı ile hacimleri arasında bir ilişki kurar. Gazların Uygulamaları Gazların çeşitli uygulama alanları bulunmaktadır. Örnek olarak:
Test Aşağıdaki test soruları ile gazlar konusundaki bilginizi ölçebilirsiniz.1. Boyle yasası hangi iki değişken arasındaki ilişkiyi ifade eder?
2. Charles yasası hangi koşulda geçerlidir?
3. Avogadro yasası neyi ifade eder?
Ekstra Bilgiler Gazlar, termodinamik yasaları çerçevesinde birçok farklı özellik gösterir. Gazların davranışları, sıcaklık, basınç ve hacim gibi değişkenlere bağlı olarak değişiklik göstermektedir. Ayrıca, gazların ideal gaz ve gerçek gaz olarak iki farklı kategorisi bulunmaktadır. İdeal gazlar, belli bir sıcaklık ve basınçta davranışları, gaz yasaları ile tam olarak açıklanabilen gazlar iken, gerçek gazlar, moleküller arası etkileşimler nedeniyle ideal gaz yasalarına tam olarak uyum sağlamazlar. Gazların fiziksel ve kimyasal özellikleri, birçok bilimsel araştırmanın ve teknolojik gelişmenin temelini oluşturur. Bu nedenle gazlar konusu, kimya eğitiminin önemli bir parçasını oluşturmaktadır. |









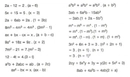























Gazların temel özellikleri arasında belirli bir şeklin olmaması ve düşük yoğunlukları dikkat çekiyor. Sizce, bu özellikler gazların günlük hayatta nasıl kullanıldığına dair ne tür örnekler sunabilir? Ayrıca, Boyle yasası ve Charles yasası gibi temel gaz yasalarının uygulanması, pratikte hangi durumlarda karşımıza çıkıyor? Bu yasaları anlamak, gazların davranışlarını daha iyi kavramamıza nasıl yardımcı olabilir?
Nursine,
Gazların Günlük Hayattaki Kullanımları
Gazların belirli bir şeklinin olmaması ve düşük yoğunlukları, birçok alanda günlük yaşamımıza entegre olmasını sağlıyor. Örneğin, hava, solunum için gerekli olan bir gaz karışımıdır ve atmosferde bulunan oksijen, yaşamın devamı için kritik bir öneme sahiptir. Ayrıca, doğalgaz, ısınma ve yemek pişirme gibi amaçlarla evlerimizde sıkça kullanılır. Bunun yanı sıra, aerosol spreylerdeki gazlar, ürünlerin püskürtülmesini sağlayarak pratik bir kullanım sunar.
Boyle ve Charles Yasalarının Uygulanması
Boyle Yasası, bir gazın hacminin, basıncı ile ters orantılı olduğunu belirtir. Bu yasa, örneğin, balonların şişirilmesi sırasında veya bir sıvının içindeki hava kabarcıklarının davranışında gözlemlenebilir. Charles Yasası ise bir gazın hacminin, sıcaklığı ile doğru orantılı olduğunu ifade eder. Bu, özellikle sıcak havalarda araba lastiklerinin basıncının artması gibi günlük durumlarda kendini gösterir.
Gaz Yasalarının Anlaşılması
Bu yasaların anlaşılması, gazların davranışlarını öngörmemize yardımcı olur. Örneğin, bir gazın sıcaklığındaki değişikliklerin hacim veya basınç üzerindeki etkilerini bilmek, mühendislik tasarımlarında ve çeşitli endüstriyel uygulamalarda kritik bir rol oynar. Bu sayede, gazların kontrollü bir şekilde kullanımı sağlanabilir ve güvenlik önlemleri alınabilir.
Bu bilgiler, gazların günlük yaşamdaki önemini ve gaz yasalarının pratikteki uygulamalarını daha iyi anlamamıza yardımcı olabilir.