
12. Sınıf Elektrokimya Konu Anlatımı
Elektrokimya, kimyasal reaksiyonların elektrik enerjisi ile ilişkisini inceleyen önemli bir bilim dalıdır. Bu yazıda, elektrokimyasal hücreler, redoks reaksiyonları, elektroliz ve galvanik hücreler gibi temel konular ele alınarak, öğrencilerin konuyu daha iyi anlamalarına yardımcı olunmaktadır.
12. Sınıf Elektrokimya Konu Anlatımı Elektrokimya, kimyanın elektriksel olaylarla ilgilenen bir dalıdır. Bu alan, kimyasal reaksiyonların elektrik enerjisi ile nasıl ilişkilendirildiğini inceler. Elektrokimya, hem teorik hem de pratik açıdan önemli bir disiplindir ve birçok endüstriyel uygulamada yer alır. Bu makalede, elektrokimyasal hücreler, elektroliz, redoks reaksiyonları ve galvanik hücreler gibi temel konular ele alınacaktır. 1. Elektrokimyasal Hücreler Elektrokimyasal hücreler, kimyasal enerjiyi elektrik enerjisine dönüştüren sistemlerdir. İki temel türü vardır:
2. Redoks Reaksiyonları Redoks (reduction-oxidation) reaksiyonları, bir maddenin elektron kaybetmesi (oksidasyon) ve diğer bir maddenin elektron kazanması (reduktion) durumudur. Bu tür reaksiyonlar, elektrokimyasal hücrelerin temelini oluşturur. Örneğin:
3. Elektroliz Elektroliz, bir elektrik akımı uygulanarak kimyasal bileşiklerin parçalanması işlemidir. Elektroliz sırasında meydana gelen olaylar, elektrolit ve elektrotlar aracılığıyla gerçekleştirilir. Örneğin, suyun elektrolizi:
Bu işlemde, su molekülleri hidrojen ve oksijen gazlarına ayrılır. Elektroliz, metal eldesi, suyun arıtılması gibi birçok endüstriyel uygulamada kullanılır. 4. Galvanik Hücreler Galvanik hücreler, kimyasal enerjinin elektrik enerjisine dönüştüğü hücrelerdir. Bir galvanik hücre, iki farklı metalin ve bu metallere ait iyon çözeltilerinin bir araya gelmesi ile oluşturulur. Örnek olarak, çinko-bakır galvanik hücresi:
Ekstra Bilgiler Elektrokimya, sadece enerji üretimi değil, aynı zamanda korozyon kontrolü ve elektrokimyasal sensörlerin geliştirilmesi gibi alanlarda da önem taşımaktadır. Örneğin, pillerin ve akülerin çalışması, elektrokimyasal süreçlere dayanmaktadır. Test Aşağıdaki soruları cevaplayarak elektrokimya konusundaki bilginizi test edebilirsiniz:
Bu makalede, 12. sınıf elektrokimya konusunun temel kavramları ve uygulama alanları ele alınmıştır. Elektrokimya, modern bilim ve teknolojinin birçok alanında önemli bir rol oynamaktadır ve bu nedenle öğrencilerin bu konuya dair sağlam bir anlayış geliştirmeleri büyük önem taşımaktadır. |









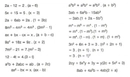























Elektrokimya konusunu öğrenirken en çok hangi kısımların zorlayıcı olduğunu merak ediyorum. Özellikle galvanik hücrelerin çalışma prensiplerini anlamak benim için biraz karmaşık. Redoks reaksiyonlarının detaylarına dair daha fazla bilgiye ihtiyaç duyduğumu hissediyorum. Siz de bu konularda benzer zorluklar yaşadınız mı? Elektroliz uygulamaları hakkında gerçek hayatta ne gibi örneklerle karşılaştınız?
Elektrokimya ve Zorluklar
Ekabir, elektrokimya konusu gerçekten de bazı öğrenciler için karmaşık bir alan olabilir. Galvanik hücrelerin çalışma prensiplerini anlamak, özellikle elektron transfer süreçlerini ve yarı hücre potansiyellerini kavramak açısından zorlayıcı hale gelebiliyor. Redoks reaksiyonları ise bu sürecin temelini oluşturduğundan, bu konuda derinlemesine bilgi edinmek oldukça önemli. Zamanla bu kavramlar daha net hale gelebilir; pratik yaparak ve örnekler üzerinden giderek anlamınızı pekiştirebilirsiniz.
Gerçek Hayatta Elektroliz Uygulamaları
Gerçek hayatta elektroliz uygulamaları oldukça yaygın. Örneğin, suyun elektrolizi ile hidrojen ve oksijen gazları elde ediliyor. Ayrıca, metal kaplama süreçlerinde de elektroliz kullanılıyor; bu, metal yüzeylerin koruyucu bir kaplama ile kaplanmasını sağlıyor. Bu tür örnekler, elektrolizin pratikte nasıl işlediğini görmek açısından faydalı olabilir. Elektroliz hakkında daha fazla bilgi edinmek, konuyu anlamanızı kolaylaştırabilir. Bu süreçleri gözlemleyerek ve deneyimleyerek, elektrokimya konusundaki anlayışınızı derinleştirebilirsiniz.