
Gaz Basıncı 8. Sınıf Konu Anlatımı
Gaz basıncı, gaz moleküllerinin bulundukları ortamda yüzeylere uyguladığı kuvveti ifade eder. Bu basınç, gazın sıcaklığı, yoğunluğu ve hacmi gibi faktörlerden etkilenir. Gazların davranışını anlamak için Boyle, Charles ve Avogadro yasaları gibi temel prensipler kullanılır. Gaz basıncının ölçülmesi, manometre ve Bourdon tüpü gibi araçlarla gerçekleştirilir. Günlük hayatta hava durumu tahmininden tıbbi uygulamalara kadar birçok alanda önemli bir rol oynar.
Gaz Basıncı Gaz basıncı, gaz moleküllerinin bulundukları ortamda duvarlara veya diğer yüzeylere uyguladığı kuvvet olarak tanımlanır. Gazlar, moleküler hareketlerinden dolayı her yöne doğru itme kuvveti uygularlar. Bu basınç, gazın sıcaklığı, yoğunluğu ve hacmi gibi çeşitli faktörlerden etkilenir. Gaz basıncı, birim alana düşen gazın moleküllerinin çarpma sayısına ve bu çarpışmaların kuvvetine bağlıdır. Basınç, genellikle Pascal (Pa) veya atmosfer (atm) cinsinden ölçülür. 1 atm, deniz seviyesinde 101325 Pa'ya eşittir. Gazların davranışını anlamak için bazı temel gaz yasaları bulunmaktadır:
Gaz basıncı, çeşitli araçlarla ölçülmektedir. En yaygın kullanılan iki alet şunlardır:
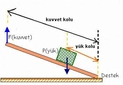
1. Bir balonun içine hava doldurduğunuzda, balonun duvarlarına uygulanan basınç artar. Bu, gaz moleküllerinin balonun içinde daha fazla hareket etmesi ve çarpması ile gerçekleşir. 2. Bir şişedeki gaz, şişenin üst kısmına sıkıştığında, bu gazın basıncı da artar. Eğer şişe açılırsa, gaz aniden dışarı çıkar ve basınç düşer. 1. Gaz basıncı nedir?
2. Boyle Yasası neyi ifade eder?
3. Aşağıdaki cihazlardan hangisi gaz basıncını ölçer?
Gaz basıncı, birçok günlük olayda önemli bir rol oynamaktadır. Örneğin, hava durumu tahminlerinde atmosfer basıncı dikkate alınır; bu nedenle meteoroloji uzmanları, hava sistemlerini anlamak için gaz basıncını analiz ederler. Ayrıca, tıpta kullanılan bazı aletler, gaz basıncını ölçerek hastalıkların teşhisinde yardımcı olur. Sonuç olarak, gaz basıncı, fiziksel bilimlerin temel bir konusudur ve günlük hayatta birçok uygulaması vardır. Gaz basıncı ve gazların davranışları, bilimsel ve mühendislik çalışmalarında büyük önem taşımaktadır. |
































Gaz basıncı hakkında daha fazla bilgi edinmek istiyorum. Özellikle, gazların davranışını belirleyen yasalar arasında hangisi günlük yaşantımızda daha fazla etkili? Boyle Yasası ile Charles Yasası arasındaki farklar neler? Bu yasaların uygulamalarını örneklerle açıklayabilir misin? Ayrıca, gaz basıncının ölçümünde kullanılan manometre ve Bourdon tüpü arasındaki temel farklılıklar nelerdir? Bu konular hakkında daha fazla bilgi almak beni çok mutlu eder.
Gazların Davranışı ve Günlük Yaşantımızdaki Etkisi
Gazların davranışını belirleyen yasalar arasında en çok bilinenleri Boyle Yasası ve Charles Yasasıdır. Günlük yaşantımızda, bu yasaların etkisini özellikle sıkışabilir gazlar ve sıcaklık değişimleri ile karşılaşırken görebiliriz. Örneğin, bir balonun içindeki gaz, balonu sıkıştırdığımızda hacminin azalmasıyla basıncının arttığını gözlemleriz. Bu, Boyle Yasası'nın bir uygulamasıdır.
Boyle Yasası ve Charles Yasası Arasındaki Farklar
Boyle Yasası, sabit sıcaklıkta bir gazın hacmi ile basıncı arasındaki ters orantıyı ifade eder. Yani, bir gazın hacmi azaldıkça basıncı artar (P1V1 = P2V2). Öte yandan, Charles Yasası, sabit basınç altında bir gazın hacminin sıcaklıkla orantılı olduğunu belirtir. Yani sıcaklık arttıkça gazın hacmi de artar (V1/T1 = V2/T2).
Uygulama Örnekleri
Boyle Yasası'nın günlük bir örneği, bir sprey kutusunun sıkıştırıldığında içindeki gazın basıncının artmasıdır. Charles Yasası ise araba lastiklerinin sıcak havada şişmesiyle ilgili bir örnek olarak verilebilir. Sıcaklık arttığında lastik içindeki gaz genişler ve bu da lastiğin basıncını yükseltir.
Manometre ve Bourdon Tüpü Arasındaki Farklılıklar
Gaz basıncını ölçmek için kullanılan manometreler, genellikle sıvı seviyesini kullanarak basıncı ölçer. Bourdon tüpü ise mekanik bir cihazdır ve gaz basıncı değiştikçe tüpün şeklinin değişmesi prensibine dayanır. Manometreler daha hassas ölçümler yaparken, Bourdon tüpleri daha dayanıklı ve taşınabilir bir yapı sunar. Manometrelerin genellikle sıvı seviyesine göre ölçüm yapması, Bourdon tüpünün ise mekanik hareketle ölçüm yapması en temel farklardır.
Bu bilgiler umarım gaz basıncı ve ilgili yasalar hakkında daha fazla anlayış kazandırır.